Синтез аммиака и азотной кислоты как пример комбинированного химического производства
В процессе изучения этого производства нужно:
а) ознакомить учащихся с сущностью синтеза аммиака и его окисления в азотную кислоту;
б) расширить уже имеющиеся у учащихся представления об условиях протекания химических реакций и способах управления ими в промышленности;
в) закрепить и углубить ранее приобретенные учащимися знания о научных принципах химических производств – дать представление о применении в химическом производстве оптимальных давлений и принципа циркуляции реагирующих веществ.
Изучение производства проводится примерно по следующему плану:
I. Синтез аммиака.
1. Азот и его свойства (повторение с записью уравнения реакции взаимодействия азота с водородом).
2. Аммиак, его получение в лаборатории, свойства и значение и народном хозяйстве (повторение с записью уравнений химических реакций и демонстрациями соответствующих опытов). Синтез аммиака в лабораторных условиях (рис. 7).
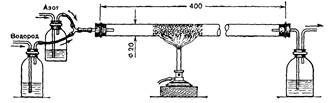
Рис 7. Синтез аммиака в лабораторных условиях
3. Синтез аммиака в промышленности: а) реакция взаимодействия азота с водородом и её обратимость, б) условия этой реакции (роль температуры, катализатора и давления), в) основные аппараты (колонна синтеза, холодильник-конденсатор, сепаратор-разделитель, компрессор и циркуляционный насос), принципы действия этих аппаратов (рис. 8).
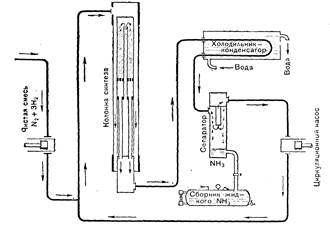
Рис. 8 Синтез аммиака в промышленности
4. Получение исходной азотоводородной смеси: а) газогенератор, б) состав генераторного газа, в) способы удаления ненужных газов (уравнения реакций), г) конвертор, д) теплообменник, е) башни для поглощения углекислого газа и окиси углерода, ж) компрессоры, з) принцип противотока и теплообмена (рис. 9).
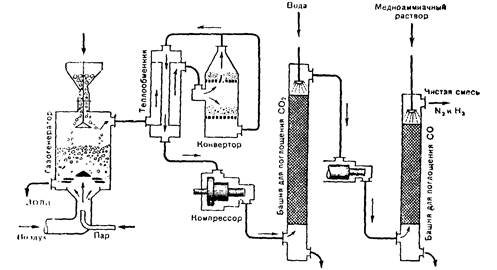
5. Обобщение и закрепление всех основных научных принципов синтеза аммиака в промышленности.
II. Окисление аммиака в азотную кислоту.
I. Реакции, лежащие в основе производства азотной кислоты: а) окисление аммиака (в присутствии катализатора) в окись азота (уравнение реакции); б) окисление окиси азота в двуокись азота и поглощение двуокиси азота водой (уравнение реакции).
2. Окисление аммиака в азотную кислоту в лабораторных условиях (демонстрация).
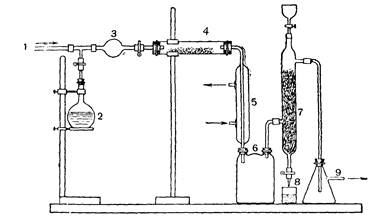
3. Получение азотной кислоты в промышленности: а) аммиачно-воздушная смесь; б) контактный аппарат; в) условия окисления; г) поглотительные башни и их действие – принцип противотока, увеличение поверхности соприкосновения газа и жидкости; поглощение двуокиси азота водой – использование давления (рис. 10). [6]
Оптимальные температуры, теплообмен, катализаторы, дробление твердых веществ и всевозможные «насадки» – важнейшие средства ускорения химических процессов – общие научные принципы, типичные для всех современных химических производств.
Характерными условиями организации химических производств являются механизация и автоматизация: применение аппаратуры непрерывного действия, а также довольно широкое использование автоматического контроля над производственным процессом и управления этим процессом. Здесь же учитель отмечает охрану труда как одну из характерных особенностей организации производства.
В процессе последующего изучения химических производств сделанные на данном занятии обобщения ещё больше конкретизируются и углубляются.
Из истории становления права как учебной дисциплины
Ценность познания окружающей действительности люди осознали еще в глубокой древности. Например, у египтян и шумеров особо чтили тех, кто умел писать и читать. Эти люди всегда занимали важные посты в государстве и считались носителями мудрости. Первыми учителями в общепринятом понимании этого слова ...
Анализ изложения темы «Сложное отношение точек. Полный четырехвершинник» в учебной
литературе
Лекции по теме «Сложное отношение точек. Полный четырехвершинник» основываются на учебных пособиях следующих авторов: С.Л. Певзнер, В.Т. Базылев, К.И. Дуничев, Л.С. Атанасян, Н.В. Ефимов. Учебное пособие С.Л. Певзнера [10] носит название «Проективная геометрия». Учебное пособие содержит материал по ...
Программа социально-правовой
защиты детства в школе
Одна из программ, посвященных социально-правовой защите ребенка в школе, проводится в городе Екатеринбург, она называется «Школа профилактики». Цель программы: повышение профессиональной компетентности специалистов в области организации профилактической деятельности в образовательном учреждении на ...
Навигация
- Главная
- Воспитание детей в семье
- Теория воспитания
- Формы обучения в высшей школе
- Идея построения адаптивной школы
- Половое воспитание
- Специальная педагогика
- Развитие образования

